宇仁醫材為國內知名塑膠類醫療器材生產商,除專業代工製造外,更協助客戶開發新材質與新產品設計,為了提供高標準的品質與服務,宇仁導入TFDA QMS與ISO13485品管系統,以確保供應商評估、進料檢驗、製程檢驗、成品檢驗、不良品管制、退貨處理等流程皆需符合國際標準規範和法規,保障產品安全有效外,同時協助客戶取得歐盟市場通行證。
其中ISO 13485明確要求醫療器材製造商需備妥DMR/DHF/DHR文件供查驗,從設計到生產過程都必須詳細完整地紀錄,但常見品質文件多達數十種,每月生產批號動輒上百批,品質紀錄至少跨物管、製造、品管三個部門,加上單量多、種類雜、紀錄慢、易漏失等問題,稽核前一個月就要開始收集整理資料,耗費的人力與時間將大大影響各部門的產能。
宇仁醫療器材 - 以BI提升DHR彙整工作效率
宇仁總經理李仲平分享資訊化前的困擾:「人、機、料、法、環,各環節都需要被驗證,查廠時蒐集資料非常耗時,例如:人員教育訓練、模具驗證,人工批次記錄流程一般包含多個步驟,每個步驟都容易發生延遲和人為錯誤。」加上批次紀錄流程依賴人工傳遞紙本資訊,但紙本檔案不易調閱查核,過程無法管控,難以有效率地將大量資料編定關聯,不利驗廠或稽核,短期可能影響出貨,長期則損害收益或商譽。
針對紙本報告難串接、多人QA造成資料分散不易追查的困擾,鼎新團隊鎖定關鍵料啟用卡控,減少人工填寫,讓宇仁能夠邊生產邊紀錄,運用自動化DHR、批次記錄、日誌和其他紙本製造記錄流程,讓生產記錄與品質事件相結合,確實掌握生產到出貨的生命週期;另一個改善關鍵,是依稽核場景提前設計彙整資訊,簡化蒐集或產出報告的步驟,隨時為驗廠做好準備。
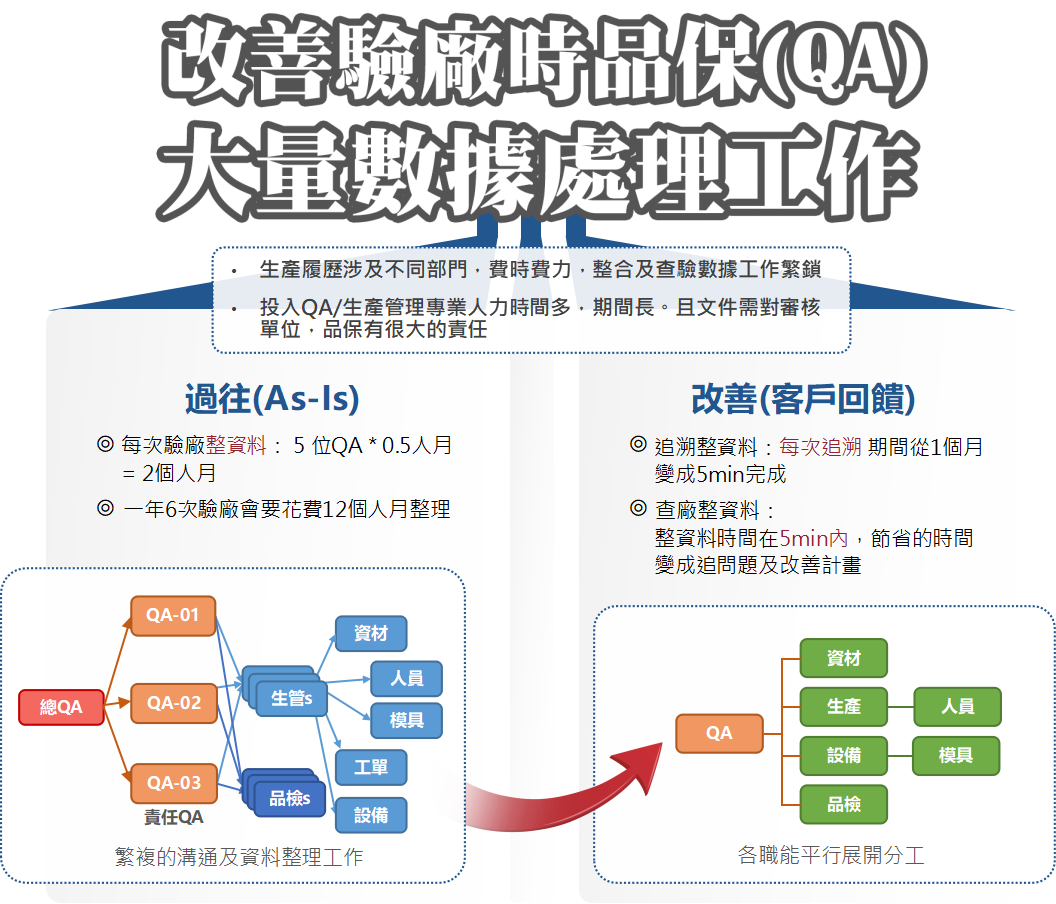
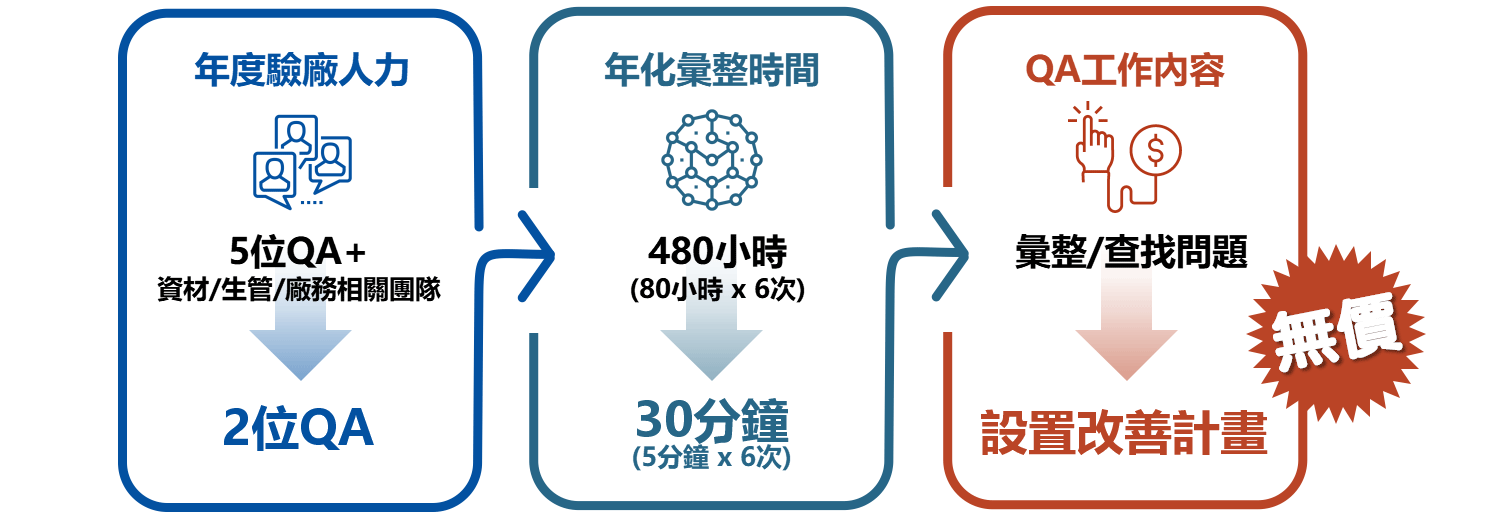
如上圖,過往驗廠資料需派工5位QA、2個人月支援,一年六次驗廠將耗費12個人月整理,不但仰賴跨部門協力,查詢追溯的工作更是充滿各種不確定,查廠前置作業原本長達一個月至兩個月,甚至得人仰馬翻地往前回推、補齊各類品保文件,現在經由鼎新系統整合,所有關聯資料可自動彙總至驗廠所需之單一QA下,透過規格化的數位資料與批次紀錄,準備時間更縮短為二、三天,履歷追溯完整度更從系統導入前的50%上升到100%;除了將製造流程資訊全面數位化,實現可視化的全同步生產記錄外,蒐集與分析生產線或批次相關的數據,可以不斷修正缺口、優化生產效率與品質。
品質與製造管控是環環相扣的過程,宇仁因應稽核實務及降低風險重點布局,貫徹人、機、料、法、環的隨批管理,精準實現「即時記錄、落實卡控、歷程追溯」,從製程一開始就設定好預防機制,有效降低生產成本,減少人員重工,杜絕生產現場的暗箱操作,同時滿足多客戶、多樣性的檢核要求,使宇仁在製造環節中具備更大競爭優勢,開創全新的成長動能。